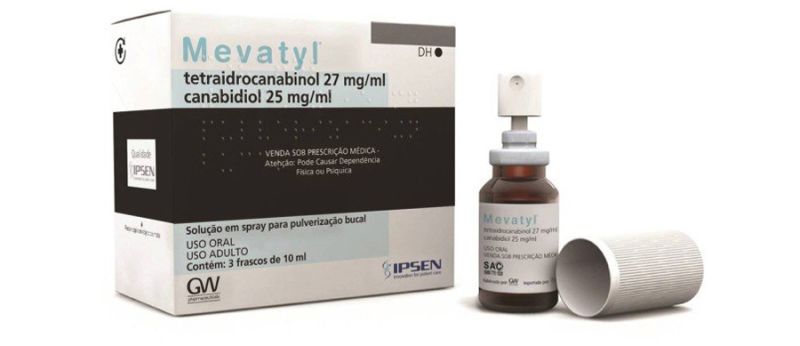
A Agência Nacional de Vigilância Sanitária (Anvisa) suspendeu, na sexta-feira (20), a distribuição e venda de um lote do spray Mevatyl, primeiro e único derivado de Cannabis registrado pela Anvisa e vendido desde 2017 nas farmácias brasileiras. O remédio é indicado para o controle dos espasmos da esclerose múltipla e custa R$ 2,8 mil a caixa com 30 ml.
Trata-se do primeiro produto à base da maconha aprovado pelo FDA americano (análogo a Anvisa dos EUA) e, fora do Brasil, é vendido com o nome comercial de Sativex, fazendo alusão à “sativa”. É produzido pela gigante GW Pharmaceuticals, do Reino Unido.
A interdição foi publicada no Diário Oficial da União, conforme noticiou o jornal O Globo. Segundo a Anvisa, a medida foi motivada por um laudo de análise para fiscalização que apresentou resultados insatisfatórios no teor de canabidiol e de THC em relação ao indicado na embalagem. O produto é apresentado com 25 mg/ml de CBD e 27 mg/ml de THC.
Agora, o laudo seguirá para análise de contraprova e a empresa tem o direito de defesa, apresentando um perito indicado por ela. Enquanto durar a interdição cautelar, o lote não pode ser comercializado ou distribuído.
Se o produto for reprovado de novo durante a investigação, serão proibidos a distribuição, o comércio e o uso e a Anvisa vai determinar o recolhimento. Se o remédio passar na contraprova, será feita uma terceira análise para decisão final. A investigação deve ser concluída num prazo máximo de 90 dias.
Além do Mevatyl, a Anvisa também aprovou a venda em farmácias do canabidiol da farmacêutica paranaense Prati-Donaduzzi. Porém, o CBD brasileiro possui apenas uma autorização sanitária válida por 5 anos, e não um registro de medicamento no órgão. Os óleos e demais produtos adquiridos via importação também não são registrados pela agência.
A empresa não se manifestou